Zakład Farmakologii Bólu
Profil naukowy
- O zakładzie
- Pracownicy
Opis zakładu
Tematyką badawczą Zakładu Farmakologii Bólu jest opracowywanie zagadnień dotyczących problematyki powstawania i utrzymywania się procesów bólowych, ze szczególnym uwzględnieniem bólu neuropatycznego, który powstaje w wyniku uszkodzenia nerwów obwodowych z powodu urazów, nowotworów, cukrzycy, stwardnienia rozsianego, niedotlenienia. Ten rodzaj bólu nie jest łagodzony przez typowe środki przeciwbólowe, dlatego też staje się często dolegliwością bez perspektyw na znaczną poprawę. Pomimo licznych badań zarówno klinicznych jak i doświadczalnych, molekularny mechanizm rozwoju bólu wciąż nie jest dokładnie poznany.
W badaniach pragniemy określić zaburzenia homeostazy w endogennych układach opioidowych, co wydaje się jedną z głównych przyczyn rozwoju bólu przewlekłego. Wzrost aktywacji endogennych systemów przeciwbólowych w odpowiedzi na uszkodzenie układu nerwowego uruchamia mechanizmy homeostazy i w konsekwencji prowadzi do nadmiernej aktywności systemów probólowych. Badania mają na celu określenie ścieżek udziału różnych probólowych peptydów w rozwoju neuropatii.
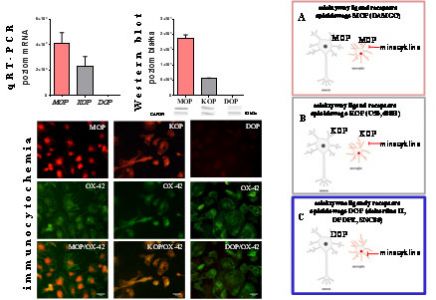
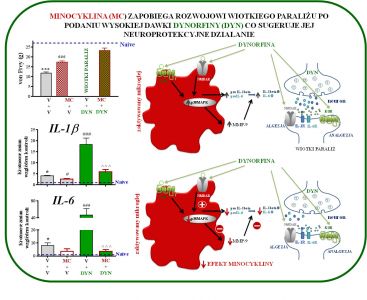
Badania z wykorzystaniem zarówno profilowania ekspresji genów jak i analizy białek wskazują, że w bólu neuropatycznym dochodzi do silnej aktywacji wielu genów neuronalnych, jak również genów związanych z odpowiedzią komórek immunologicznych, w tym z aktywacją mikrogleju. Prowadzone badania są istotne, ponieważ obecnie brak danych dotyczących prób hamowania mikrogleju czy czynników prozapalnych takich jak IL-1beta, CCL2, CCL5, a także wykorzystania inhibitorów szlaków wewnątrzkomórkowych NF-B, ERK1/2, p38MAPK przy stosowaniu opioidów w bólu neuropatycznym. W badaniach poszukujemy nowych punktów uchwytu również dla skutecznej terapii neuropatii cukrzycowej. Prowadzone eksperymenty wykazały, że modulacja zmian neuroimmunologicznych na skutek działania pentoksyfiliny (inhibitor pozapalnych cytokin), minocykliny (inhibitor p38MAPK), partenolidu (inhibitor NF-κB), U0126 (inhibitor ERK1/2), SB203580 (inhibitor p38MAPK) PD98059 (inhibitor MAPKK) w bólu neuropatycznym osłabia jego rozwój a także nasila efektywność opioidów. Mamy nadzieję, że wyniki naszych badań stworzą eksperymentalne podstawy do zastosowanie w przyszłości skojarzonej terapii stosowanych w klinice opioidowych leków przeciwbólowych z inhibitorami gleju lub innymi substancjami modulującymi syntezę lub działanie prozapalnych czynników, w celu zwiększenia skuteczności leków przeciwbólowych w terapii bólu neuropatycznego.
Metody badawcze




Pracownicy zakładu
prof. dr hab. Barbara Przewłocka
dr Anna Piotrowska-Murzyn
dr hab. Ewelina Rojewska-Mendel
dr Agata Ciechanowska
mgr Wioletta Makuch
mgr Aleksandra Bober
mgr Katarzyna Ciapała
Agnieszka Młynarczyk
mgr inż. Katarzyna Pawlik-Szczerba
Dokonania naukowe
- Publikacje
- Granty
Grant
PRELUDIUM 12 2016/23/N/NZ7/00356 Określenie mechanizmów i potencjalnych punktów uchwytu dla terapii bólu neuropatycznego poprzez zbadanie interakcji farmakologicznych pomiędzy substancjami modulującymi aktywność gleju a lekami opioidowymi
Dr Anna Piotrowska-Murzyn
Grant
OPUS 22 2021/43/B/NZ7/00230 Nowe strategie w farmakoterapii bólu neuropatycznego oparte na modulacji układu chemokin i jego wpływie na rozwój tolerancji opioidowej
prof. dr hab. Joanna Mika
Minocycline reduces the injury-induced expression of prodynorphin and pronociceptin in the dorsal root ganglion in a rat model of neuropathic pain
Mika, J., Rojewska, E., Makuch, W., Przewlocka, B.
DOI: 10.1016/j.neuroscience.2009.11.064
Efficacy of tramadol in combination with doxepin or venlafaxine in inhibition of nociceptive process in the rat model of neuropathic pain: An isobolographic analysis
Wrzosek, A., Obara, I., Wordliczek, J., Przewlocka, B.
DOI:
Local peripheral opioid effects and expression of opioid genes in the spinal cord and dorsal root ganglia in neuropathic and inflammatory pain
Obara, I., Parkitna, J.R., Korostynski, M., Makuch, W., Kaminska, D., Przewlocka, B., Przewlocki, R.
DOI: 10.1016/j.pain.2008.12.006
Differential activation of spinal microglial and astroglial cells in a mouse model of peripheral neuropathic pain
Mika, J., Osikowicz, M., Rojewska, E., Korostynski, M., Wawrzczak-Bargiela, A., Przewlocki, R., Przewlocka, B.
DOI: 10.1016/j.ejphar.2009.09.030
Glial inhibitors influence the mRNA and protein levels of mGlu2/3, 5 and 7 receptors and potentiate the analgesic effects of their ligands in a mouse model of neuropathic pain
Osikowicz, M., Skup, M., Mika, J., Makuch, W., Czarkowska-Bauch, J., Przewlocka, B.
DOI: 10.1016/j.pain.2009.09.002
Peripheral antinociceptive effects of MC4 receptor antagonists in a rat model of neuropathic pain - A biochemical and behavioral study
Starowicz, K., Mousa, S.A., Obara, I., Chocyk, A., Przewłocki, R., Wȩdzony, K., Machelska, H., Przewłocka, B.
DOI: 10.1016/S1734-1140(09)70171-9
Attenuation of morphine tolerance by minocycline and pentoxifylline in naive and neuropathic mice
Mika, J., Wawrzczak-Bargiela, A., Osikowicz, M., Makuch, W., Przewlocka, B.
DOI: 10.1016/j.bbi.2008.07.005
Glutamate receptor ligands attenuate allodynia and hyperalgesia and potentiate morphine effects in a mouse model of neuropathic pain
Osikowicz, M., Mika, J., Makuch, W., Przewlocka, B.
DOI: 10.1016/j.pain.2008.03.017
Interleukin-1alpha has antiallodynic and antihyperalgesic activities in a rat neuropathic pain model
Mika, J., Korostynski, M., Kaminska, D., Wawrzczak-Bargiela, A., Osikowicz, M., Makuch, W., Przewlocki, R., Przewlocka, B.
DOI: 10.1016/j.pain.2008.02.015
Mild postnatal manipulation reduces proenkephalin mRNA in the striatum in developing mice and increases morphine conditioned place preference in adulthood
D'Amato, F.R., Barakos, E., Ziolkowska, B., Obara, I., Przewlocka, B., Pavone, F.
DOI: 10.1016/j.pbb.2007.04.008