Zakład Farmakologii Bólu
Profil naukowy
- O zakładzie
- Pracownicy
Opis zakładu
Tematyką badawczą Zakładu Farmakologii Bólu jest opracowywanie zagadnień dotyczących problematyki powstawania i utrzymywania się procesów bólowych, ze szczególnym uwzględnieniem bólu neuropatycznego, który powstaje w wyniku uszkodzenia nerwów obwodowych z powodu urazów, nowotworów, cukrzycy, stwardnienia rozsianego, niedotlenienia. Ten rodzaj bólu nie jest łagodzony przez typowe środki przeciwbólowe, dlatego też staje się często dolegliwością bez perspektyw na znaczną poprawę. Pomimo licznych badań zarówno klinicznych jak i doświadczalnych, molekularny mechanizm rozwoju bólu wciąż nie jest dokładnie poznany.
W badaniach pragniemy określić zaburzenia homeostazy w endogennych układach opioidowych, co wydaje się jedną z głównych przyczyn rozwoju bólu przewlekłego. Wzrost aktywacji endogennych systemów przeciwbólowych w odpowiedzi na uszkodzenie układu nerwowego uruchamia mechanizmy homeostazy i w konsekwencji prowadzi do nadmiernej aktywności systemów probólowych. Badania mają na celu określenie ścieżek udziału różnych probólowych peptydów w rozwoju neuropatii.
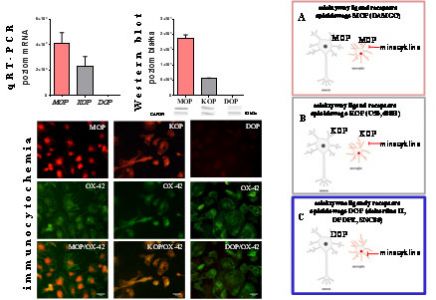
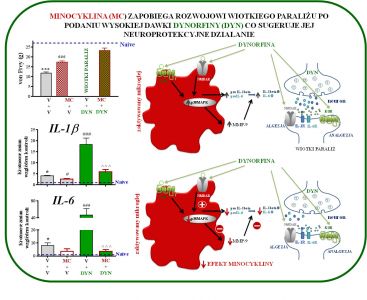
Badania z wykorzystaniem zarówno profilowania ekspresji genów jak i analizy białek wskazują, że w bólu neuropatycznym dochodzi do silnej aktywacji wielu genów neuronalnych, jak również genów związanych z odpowiedzią komórek immunologicznych, w tym z aktywacją mikrogleju. Prowadzone badania są istotne, ponieważ obecnie brak danych dotyczących prób hamowania mikrogleju czy czynników prozapalnych takich jak IL-1beta, CCL2, CCL5, a także wykorzystania inhibitorów szlaków wewnątrzkomórkowych NF-B, ERK1/2, p38MAPK przy stosowaniu opioidów w bólu neuropatycznym. W badaniach poszukujemy nowych punktów uchwytu również dla skutecznej terapii neuropatii cukrzycowej. Prowadzone eksperymenty wykazały, że modulacja zmian neuroimmunologicznych na skutek działania pentoksyfiliny (inhibitor pozapalnych cytokin), minocykliny (inhibitor p38MAPK), partenolidu (inhibitor NF-κB), U0126 (inhibitor ERK1/2), SB203580 (inhibitor p38MAPK) PD98059 (inhibitor MAPKK) w bólu neuropatycznym osłabia jego rozwój a także nasila efektywność opioidów. Mamy nadzieję, że wyniki naszych badań stworzą eksperymentalne podstawy do zastosowanie w przyszłości skojarzonej terapii stosowanych w klinice opioidowych leków przeciwbólowych z inhibitorami gleju lub innymi substancjami modulującymi syntezę lub działanie prozapalnych czynników, w celu zwiększenia skuteczności leków przeciwbólowych w terapii bólu neuropatycznego.
Metody badawcze




Pracownicy zakładu
prof. dr hab. Barbara Przewłocka
dr Anna Piotrowska-Murzyn
dr hab. Ewelina Rojewska-Mendel
dr Agata Ciechanowska
mgr Wioletta Makuch
mgr Aleksandra Bober
mgr Katarzyna Ciapała
Agnieszka Młynarczyk
mgr inż. Katarzyna Pawlik-Szczerba
Dokonania naukowe
- Publikacje
- Granty
Grant
PRELUDIUM 12 2016/23/N/NZ7/00356 Określenie mechanizmów i potencjalnych punktów uchwytu dla terapii bólu neuropatycznego poprzez zbadanie interakcji farmakologicznych pomiędzy substancjami modulującymi aktywność gleju a lekami opioidowymi
Dr Anna Piotrowska-Murzyn
Grant
OPUS 22 2021/43/B/NZ7/00230 Nowe strategie w farmakoterapii bólu neuropatycznego oparte na modulacji układu chemokin i jego wpływie na rozwój tolerancji opioidowej
prof. dr hab. Joanna Mika
PD98059 influences immune factors and enhances opioid analgesia in model of neuropathy
Rojewska, E., Popiolek-Barczyk, K., Kolosowska, N., Piotrowska, A., Zychowska, M., Makuch, W., Przewlocka, B., Mika, J.
DOI: 10.1371/journal.pone.0138583
Anandamide, acting via CB2 receptors, alleviates LPS-induced neuroinflammation in rat primary microglial cultures
Malek, N., Popiolek-Barczyk, K., Mika, J., Przewlocka, B., Starowicz, K.
DOI: 10.1155/2015/130639
IL-1 receptor antagonist improves morphine and buprenorphine efficacy in a rat neuropathic pain model
Pilat, D., Rojewska, E., Jurga, A.M., Piotrowska, A., Makuch, W., Przewlocka, B., Mika, J.
DOI: 10.1016/j.ejphar.2015.05.058
Synthesis and biological evaluation of compact, conformationally constrained bifunctional opioid agonist - Neurokinin-1 antagonist peptidomimetics
Guillemyn, K., Kleczkowska, P., Lesniak, A., Dyniewicz, J., Van Der Poorten, O., Van Den Eynde, I., Keresztes, A., Varga, E., Lai, J., Porreca, F., Chung, N.N., Lemieux, C., Mika, J., Rojewska, E., Makuch, W., Van Duppen, J., Przewlocka, B., Vanden Broeck, J., Lipkowski, A.W., Schiller, P.W., Tourwé, D., Ballet, S.
DOI: 10.1016/j.ejmech.2014.12.033
The influence of microglia activation on the efficacy of amitriptyline, doxepin, milnacipran, venlafaxine and fluoxetine in a rat model of neuropathic pain
Zychowska, M., Rojewska, E., Makuch, W., Przewlocka, B., Mika, J.
DOI: 10.1016/j.ejphar.2014.11.022
Dual Alleviation of Acute and Neuropathic Pain by Fused Opioid Agonist-Neurokinin 1 Antagonist Peptidomimetics
Betti, C., Starnowska, J., Mika, J., Dyniewicz, J., Frankiewicz, L., Novoa, A., Bochynska, M., Keresztes, A., Kosson, P., Makuch, W., Van Duppen, J., Chung, N.N., Vanden Broeck, J., Lipkowski, A.W., Schiller, P.W., Janssens, F., Ceusters, M., Sommen, F., Meert, T., Przewlocka, B., Tourwé, D., Ballet, S.
DOI: 10.1021/acsmedchemlett.5b00359
A multi-target approach for pain treatment: Dual inhibition of fatty acid amide hydrolase and TRPV1 in a rat model of osteoarthritis
Malek, N., Mrugala, M., Makuch, W., Kolosowska, N., Przewlocka, B., Binkowski, M., Czaja, M., Morera, E., Di Marzo, V., Starowicz, K.
DOI: 10.1097/j.pain.0000000000000132
Delta-opioid receptor analgesia is independent of microglial activation in a rat model of neuropathic pain
Mika, J., Popiolek-Barczyk, K., Rojewska, E., Makuch, W., Starowicz, K., Przewlocka, B.
DOI: 10.1371/journal.pone.0104420
Involvement of pro- and antinociceptive factors in minocycline analgesia in rat neuropathic pain model
Rojewska, E., Popiolek-Barczyk, K., Jurga, A.M., Makuch, W., Przewlocka, B., Mika, J.
DOI: 10.1016/j.jneuroim.2014.09.020
Minocycline Enhances the Effectiveness of Nociceptin/Orphanin FQ during Neuropathic Pain
Popiolek-Barczyk, K., Rojewska, E., Jurga, A.M., Makuch, W., Zador, F., Borsodi, A., Piotrowska, A., Przewlocka, B., Mika, J.
DOI: 10.1155/2014/762930